- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2024-02-01 14:13.
- Zadnja promjena 2025-01-23 12:19.
Jeste li ikada ostavili bocu vode na vrućem suncu nekoliko sati i čuli lagani zvuk "siktanja" kad ste je otvorili? To je zbog principa koji se naziva tlak pare. U kemiji je tlak pare tlak koji stvaraju stijenke zatvorene posude kada kemijska tvar u njoj ispari (pretvori se u plin). Da biste pronašli tlak pare na određenoj temperaturi, upotrijebite Clausius-Clapeyronovu jednadžbu: ln (P1/P2) = (ΔHpare/R) ((1/T2) - (1/T1)).
Korak
Metoda 1 od 3: Korištenje Clausius-Clapeyronove jednadžbe
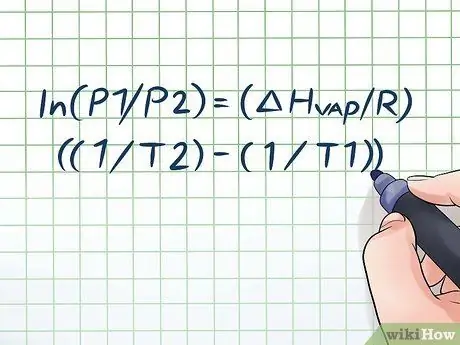
Korak 1. Zapišite Clausius-Clapeyronovu jednadžbu
Formula koja se koristi za izračun tlaka pare s promjenom tlaka pare tijekom vremena naziva se Clausius -Clapeyronova jednadžba (nazvana po fizičarima Rudolfu Clausiusu i Benoîtu Paulu mile Clapeyron.) To je u osnovi formula koja će vam trebati za rješavanje većine vrsta problema Pitanja o tlaku pare često se nalaze na satovima fizike i kemije. Formula je sljedeća: ln (P1/P2) = (ΔHpare/R) ((1/T2) - (1/T1)). U ovoj formuli varijable predstavljaju:
-
Hpare:
Entalpija isparavanja tekućine. Ova entalpija obično se može pronaći u tablici na poleđini udžbenika kemije.
-
R:
Realna/univerzalna plinska konstanta, ili 8,314 J/(K × Mol).
-
P1:
Temperatura pri kojoj je poznat tlak pare (ili početna temperatura).
-
T2:
Temperatura pri kojoj je tlak pare nepoznat/koji se želi pronaći (ili konačna temperatura).
-
P1 i P2:
Tlak pare pri temperaturama T1, odnosno T2.

Korak 2. Unesite varijable koje poznajete
Clausius-Clapeyronova jednadžba izgleda komplicirano jer ima puno različitih varijabli, ali zapravo nije tako teško ako imate prave informacije. Većina osnovnih problema tlaka pare navest će dvije vrijednosti temperature i jednu vrijednost tlaka ili dvije vrijednosti tlaka i jednu vrijednost temperature - jednom kad to shvatite, rješavanje ove jednadžbe vrlo je jednostavno.
- Na primjer, recimo da nam je rečeno da imamo spremnik pun tekućine na 295 K čiji je tlak pare 1 atmosfera (atm). Naše pitanje je: Koliki je tlak pare pri 393 K? Imamo dvije vrijednosti temperature i jednu vrijednost tlaka pa ostale vrijednosti tlaka možemo pronaći pomoću Clausius-Clapeyronove jednadžbe. Uključivanjem naših varijabli dobivamo ln (1/P2) = (ΔHpare/R) ((1/393) - (1/295)).
- Imajte na umu da za Clausius-Clapeyronovu jednadžbu uvijek morate koristiti vrijednost temperature Kelvin. Možete koristiti bilo koju vrijednost tlaka sve dok su vrijednosti za P1 i P2 iste.

Korak 3. Unesite svoje konstante
Clausius-Clapeyronova jednadžba ima dvije konstante: R i Hpare. R je uvijek jednako 8.314 J/(K × Mol). Međutim, H.pare (entalpija isparavanja) ovisi o tvari čiji pritisak pare tražite. Kao što je gore napomenuto, obično možete pronaći vrijednosti Hpare za različite tvari iza udžbenika iz kemije ili fizike ili na internetu (kao, na primjer, ovdje.)
-
U našem primjeru, pretpostavimo da je naša tekućina čista voda.
Pogledamo li u tablici vrijednosti Hpare, nalazimo da je Hpare čista voda iznosi oko 40,65 KJ/mol. Budući da je naša vrijednost H u džulima, a ne u kilodžulima, možemo je pretvoriti u 40.650 J/mol.
- Uključujući naše konstante, dobivamo ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
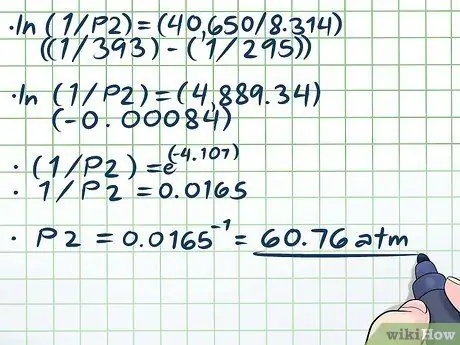
Korak 4. Riješite jednadžbu
Nakon što ste u jednadžbu uključili sve varijable osim one koju tražite, krenite u rješavanje jednadžbe prema pravilima obične algebre.
-
Jedini teški dio rješavanja naše jednadžbe (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) rješava prirodni zapisnik (ln). Da biste uklonili prirodni zapisnik, samo upotrijebite obje strane jednadžbe kao eksponente za matematičku konstantu e. Drugim riječima, ln (x) = 2 → eln (x) = e2 → x = e2.
- Riješimo sada našu jednadžbu:
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0,0165
-
P2 = 0,0165-1 = 60, 76 atm
To ima smisla - u zatvorenom spremniku, podizanjem temperature na gotovo 100 stupnjeva (na gotovo 20 stupnjeva iznad vrelišta) proizvest će se mnogo pare, brzo povećavajući tlak.
Metoda 2 od 3: Nalaženje tlaka pare otopljenom otopinom
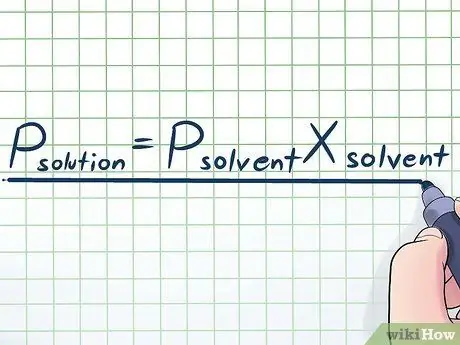
Korak 1. Zapišite Raoultov zakon
U stvarnom životu rijetko radimo s čistom tekućinom - obično radimo s tekućinom koja je mješavina nekoliko različitih tvari. Neke od najčešće korištenih smjesa nastaju otapanjem male količine određene kemikalije koja se naziva otopljena tvar u mnogim kemikalijama koje se nazivaju otapalo. U tim je slučajevima korisno znati jednadžbu pod nazivom Raoultov zakon (nazvanu po fizičaru François-Marie Raoult), koja je napisana ovako: Potopljen= Potapaloxotapalo. U ovoj formuli varijable predstavljaju;
-
Potopljen:
Tlak pare cijele otopine (svi elementi zajedno)
-
Potapalo:
Tlak pare otapala
-
xotapalo:
Molarni udio otapala
- Ne brinite ako ne poznajete pojmove poput molarnog udjela - objasnit ćemo ih u sljedećih nekoliko koraka.

Korak 2. Odredite otapalo i otopljenu tvar u vašoj otopini
Prije nego što možete izračunati tlak pare miješane tekućine, morate identificirati tvari koje koristite. Podsjećamo, otopina nastaje kada se otopljena tvar otopi u otapalu - kemikalija koja se otapa uvijek se naziva otopljena tvar, a kemikalija koja ga otapa uvijek se naziva otapalo.
- Poradimo na jednostavnim primjerima u ovom odjeljku kako bismo ilustrirali koncepte o kojima govorimo. Za naš primjer, recimo da želimo pronaći tlak pare šećernog sirupa. Tradicionalno, šećerni sirup je šećer topiv u vodi (omjer 1: 1), pa to možemo reći šećer je naša otopljena tvar, a voda naše otapalo.
- Imajte na umu da je kemijska formula za saharozu (stolni šećer) C12H22O.11. Ova kemijska formula bit će vrlo važna.
Korak 3. Pronađite temperaturu otopine
Kao što smo vidjeli u gornjem odjeljku Clausius Clapeyron, temperatura tekućine utjecat će na njezin tlak pare. Općenito, što je temperatura viša, pritisak pare je veći - s porastom temperature više će tekućine ispariti i formirati paru, povećavajući tlak u spremniku.
U našem primjeru, recimo da je temperatura šećernog sirupa u ovom trenutku 298 K (oko 25 C).
Korak 4. Pronađite tlak pare otapala
Referentni kemijski materijali obično imaju vrijednosti tlaka pare za mnoge uobičajeno korištene tvari i spojeve, ali te vrijednosti tlaka obično vrijede samo ako tvar ima temperaturu od 25 C/298 K ili njezino vrelište. Ako vaša otopina ima jednu od ovih temperatura, možete upotrijebiti referentnu vrijednost, ali ako ne, morat ćete pronaći tlak pare pri toj temperaturi.
- Clausius -Clapeyron može pomoći - upotrijebite referentni tlak pare i 298 K (25 C) za P1 odnosno T1.
- U našem primjeru, naša mješavina ima temperaturu od 25 ° C, pa lako možemo koristiti našu jednostavnu referentnu tablicu. Znamo da pri 25 C voda ima tlak pare od 23,8 mm HG

Korak 5. Pronađite molarni udio otapala
Posljednje što moramo učiniti prije nego što to riješimo je pronaći molarni udio našeg otapala. Pronalaženje molarnog udjela je jednostavno: samo pretvorite svoje spojeve u molove, a zatim pronađite postotak svakog spoja u ukupnom broju molova u tvari. Drugim riječima, molarni udio svakog spoja jednak je (molovi spoja)/(ukupan broj molova u tvari).
-
Pretpostavimo da naš recept za upotrebu šećernog sirupa 1 litra (L) vode i 1 litra saharoze (šećera).
U tom slučaju moramo pronaći broj molova svakog spoja. Da bismo to učinili, pronaći ćemo masu svakog spoja, a zatim upotrijebiti molarnu masu tvari da je pretvorimo u molove.
- Masa (1 L vode): 1.000 grama (g)
- Masa (1 L sirovog šećera): približno 1,056,8 g
- Molovi (voda): 1.000 grama × 1 mol/18.015 g = 55.51 mol
- Molovi (saharoza): 1.056, 7 grama × 1 mol/342.2965 g = 3.08 mola (imajte na umu da molarnu masu saharoze možete pronaći iz njene kemijske formule, C12H22O.11.)
- Ukupno moli: 55,51 + 3,08 = 58,59 mol
- Molarni udio vode: 55, 51/58, 59 = 0, 947
Korak 6. Završite
Konačno, imamo sve što nam je potrebno za rješavanje naše Raoultove jednadžbe zakona. Ovaj dio je vrlo jednostavan: samo uključite svoje vrijednosti za varijable u pojednostavljenu jednadžbu Raoultovog zakona na početku ovog odjeljka (Potopljen = Potapaloxotapalo).
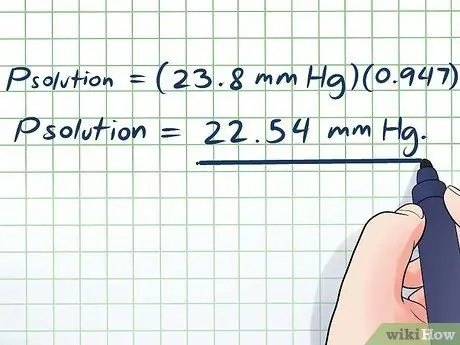
- Unoseći naše vrijednosti, dobivamo:
- Priješenje = (23,8 mm Hg) (0, 947)
-
Priješenje = 22,54 mm Hg.
Rezultat ima smisla - u molskim izrazima vrlo je malo šećera otopljeno u puno vode (iako u stvarnom svijetu oba sastojka imaju isti volumen), pa će se tlak pare samo malo smanjiti.
Metoda 3 od 3: Nalaženje tlaka pare u posebnim slučajevima

Korak 1. Budite oprezni sa standardnim uvjetima temperature i tlaka
Znanstvenici često koriste skup vrijednosti temperature i tlaka kao "standard" za upotrebu. Te se vrijednosti nazivaju standardna temperatura i tlak (ili STP). Problemi s tlakom pare često se odnose na STP uvjete, pa je važno zapamtiti ove vrijednosti. STP vrijednosti definirane su kao:
- Temperatura: 273, 15 K / 0 C / 32 F.
- Pritisak: 760 mm Hg / 1 atm / 101, 325 kilopaskala

Korak 2. Preuredite Clausius-Clapeyronovu jednadžbu kako biste pronašli ostale varijable
U našem primjeru u 1. dijelu vidjeli smo da je Clausius -Clapeyronova jednadžba vrlo korisna za pronalaženje tlaka pare za čiste tvari. Međutim, neće vas sva pitanja pitati da potražite P1 ili P2 - mnogi će od vas tražiti da pronađete vrijednost temperature ili ponekad čak i vrijednost H.pare. Srećom, u tim je slučajevima točan odgovor jednostavno pitanje preuređivanja jednadžbe tako da varijable koje želite riješiti budu odvojene s jedne strane znaka jednakosti.
- Na primjer, recimo da imamo nepoznatu tekućinu s tlakom pare od 25 torr na 273 K i 150 torr na 325 K, i želimo pronaći entalpiju isparavanja te tekućine (ΔHpare). To možemo riješiti ovako:
- ln (P1/P2) = (ΔHpare/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHpare/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hpare Sada unosimo naše vrijednosti:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = Hpare
- 8, 314 J/(K × Mol) × 3,033, 90 = Hpare = 25,223, 83 J/mol

Korak 3. Izračunajte tlak pare otopljene tvari kada tvar stvara paru
U našem gore navedenom primjeru Raoultovog zakona, naša otopljena tvar, šećer, ne vrši nikakav pritisak sam pri normalnim temperaturama (pomislite - kada ste zadnji put vidjeli da zdjela šećera ispari u vašem gornjem ormaru?) Međutim, kada je vaša otopljena tvar to učinila ispari, to će utjecati na vaš tlak pare. To objašnjavamo korištenjem modificirane verzije Raoultove jednadžbe zakona: Priješenje = (Strspojxspoj) Simbol sigma (Σ) znači da samo trebamo zbrajati sve tlakove pare različitih spojeva da bismo dobili odgovor.
- Na primjer, recimo da imamo otopinu napravljenu od dvije kemikalije: benzena i toluena. Ukupni volumen otopine je 12 mililitara (mL); 60 ml benzena i 60 ml toluena. Temperatura otopine je 25 ° C, a tlakovi pare svake od ovih kemikalija na 25 ° C iznose 95,1 mm Hg za benzen i 28,4 mm Hg za toluen. S tim vrijednostima pronađite tlak pare otopine. To možemo učiniti na sljedeći način, koristeći standardne gustoće, molarnu masu i tlak pare za naše dvije kemikalije:
- Masa (benzen): 60 ml = 0,060 L & puta 876,50 kg/1 000 L = 0,053 kg = 53 g
- Masa (toluen): 0,060 L & puta 866, 90 kg/1.000 L = 0,052 kg = 52 g
- Mol (benzen): 53 g × 1 mol/78, 11 g = 0,679 mol
- Moli (toluen): 52 g × 1 mol/92, 14 g = 0,564 mol
- Ukupno molova: 0,679 + 0,564 = 1,243
- Molski udio (benzen): 0,679/1, 243 = 0,546
- Molski udio (toluen): 0,564/1, 243 = 0,454
- Rješenje: Priješenje = Pbenzenxbenzen + Ptoluenxtoluen
- Priješenje = (95,1 mm Hg) (0, 546) + (28,4 mm Hg) (0, 454)
- Priješenje = 51,92 mm Hg + 12,89 mm Hg = 64, 81 mm Hg
Savjeti
- Za korištenje gore navedene Clausiusove Clapeyronove jednadžbe, temperatura se mora mjeriti u Kelvinima (napisana kao K). Ako imate temperaturu u Celzijusima, morate je pretvoriti prema sljedećoj formuli: Tk = 273 + T.c
- Gore navedene metode mogu se koristiti jer je energija točno proporcionalna količini primijenjene topline. Temperatura tekućine jedini je faktor okoliša koji utječe na tlak pare.






