- Autor Jason Gerald [email protected].
- Public 2023-12-16 11:15.
- Zadnja promjena 2025-01-23 12:19.
Razrjeđivanje je postupak razrjeđivanja koncentrirane otopine. Postoje različiti razlozi zašto bi netko htio napraviti razrjeđivanje, u rasponu od ozbiljnih do jednostavnih razloga. Na primjer, biokemičari razrjeđuju otopine iz svojih koncentriranih oblika kako bi napravili nova rješenja za uporabu u pokusima, dok, s druge strane, barmeni često razrjeđuju žestoka pića bezalkoholnim pićima ili sokovima kako bi kokteli bili ukusniji. Opća formula za izračunavanje razrjeđenja je C1V.1 = C2V.2, s C.1 i C.2 predstavlja početnu i konačnu koncentraciju otopine, odnosno V1 i V.2 predstavlja volumen.
Korak
Metoda 1 od 2: Precizno razrjeđivanje koncentrata putem jednadžbe razrjeđivanja

Korak 1. Odredite što znate i ne znate
Razrjeđivanje u kemiji obično znači uzimanje male količine otopine za koju znate koncentraciju, zatim dodavanje neutralne tekućine (poput vode) kako bi se dobila nova otopina s većim volumenom, ali manjom koncentracijom. To se vrlo često radi u kemijskim laboratorijima, jer se radi učinkovitosti reagensi često skladište u vrlo visokim koncentracijama, koji se zatim razrjeđuju za uporabu u pokusima. Obično ćete u većini situacija u stvarnom svijetu znati koncentraciju početne otopine i koncentraciju ili volumen za koji želite da vam bude konačna koncentracija, ali ne i volumen početne otopine koji vam je potreban za dobivanje konačne otopine.
- Međutim, u drugim situacijama (osobito u školskim problemima) možda ćete morati pronaći druge dijelove slagalice - na primjer, možda ćete dobiti početni volumen i koncentraciju, a zatim zatražiti da pronađete konačnu koncentraciju ako razrijedite otopinu. do željene zapremine. U svakom slučaju razrjeđivanja, korisno je zabilježiti poznate i nepoznate varijable prije početka.
-
Završimo primjere pitanja. Pretpostavimo da se od nas traži da razrijedimo 5 M otopinu vodom da napravimo 1 L otopine mM. U ovom slučaju znamo koncentraciju naše početne otopine te volumen i konačnu koncentraciju koju želimo, ali ne i količinu početne otopine koju moramo dodati vodom kako bismo postigli željeni rezultat.
Podsjetnik: U kemiji je M mjerenje koncentracije koja se naziva Molarnost, a označava molove tvari po litri
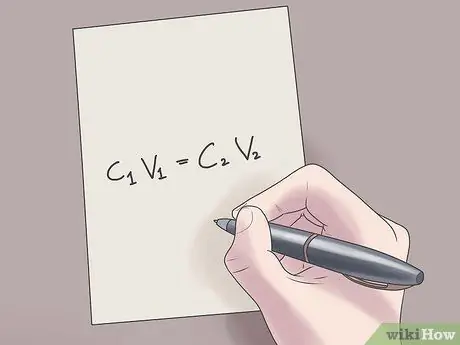
Korak 2. Uključite svoje vrijednosti u formulu C1V.1 = C2V.2.
U ovoj formuli, C1 je početna koncentracija otopine, V1 je volumen početne otopine, C2 je konačna koncentracija otopine, a V2 je volumen konačne otopine. Uključivanjem poznatih vrijednosti u ovu jednadžbu lakše ćete pronaći nepoznate vrijednosti.
- Možda će vam biti korisno staviti upitnik ispred jedinice koju želite tražiti kako biste je lakše riješili.
-
Nastavimo naš primjer. Vrijednosti koje znamo unijet ćemo na sljedeći način:
- C1V.1 = C2V.2
- (5 M) V1 = (1 mM) (1 L). Naše dvije koncentracije imaju različite jedinice. Zaustavimo se ovdje i prijeđimo na sljedeći korak.

Korak 3. Razmotrite sve razlike u jedinicama
Budući da rješenja uključuju promjene koncentracije (koje ponekad mogu biti prilično velike), nije neobično da dvije varijable u vašoj jednadžbi imaju različite jedinice. Iako je to lako previdjeti, nejednake jedinice u vašoj jednadžbi mogu uzrokovati netočan odgovor. Prije završetka pretvorite sve vrijednosti s različitim jedinicama koncentracije i/ili volumena.
-
U našem primjeru koristimo različite jedinice za koncentracije M (molari) i mM (milimolari). Promijenimo naše drugo mjerenje u M:
- 1 mM × 1 M/1.000 mM
- = 0,001 M

Korak 4. Završite
Nakon što su sve jedinice jednake, riješite svoju jednadžbu. To se gotovo uvijek može učiniti jednostavnom algebrom.
-
Ovdje zaustavljamo naš primjer problema: (5 M) V1 = (1 mM) (1 L). Pronađimo vrijednost V1 s našom novom jedinicom.
- (5 M) V1 = (0,001 M) (1 L)
- V.1 = (0,001 M) (1 L)/(5 M).
-
V.1 = 0,0002 L ili 0,2 ml.

Korak 5. Shvatite kako pravilno koristiti svoj odgovor
Pretpostavimo da ste pronašli svoju vrijednost koja nedostaje, ali niste sigurni kako koristiti ove nove podatke u stvarnom razrjeđenju koje trebate učiniti. To je razumljivo - jezik matematike i znanosti ponekad se ne podudara sa stvarnim svijetom. Kad znate četiri vrijednosti u jednadžbi C1V.1 = C2V.2, učinite razrjeđivanje na sljedeći način:
- Izmjerite volumen V1 iz otopine s koncentracijom C1. Zatim dodajte dovoljno razrjeđivača (vode itd.) Kako bi ukupni volumen bio V2. Ovo novo rješenje imat će željenu koncentraciju (C2).
- U našem primjeru, na primjer, prvo izmjerimo 0,2 ml 5 M otopine. Zatim ćemo dodati dovoljno vode da povećamo volumen otopine na 1 L: 1 L - 0,0002 L = 0,9998 L, ili 999, 8 ml. Drugim riječima, našoj otopini za mali uzorak dodat ćemo 999,8 ml vode. Naša nova, razrijeđena otopina ima koncentraciju od 1 mM, što je naša željena koncentracija.
Metoda 2 od 2: Izrada jednostavne i praktične otopine za razrjeđivanje

Korak 1. Za informacije pročitajte pakiranje
Postoje različiti razlozi zašto biste možda htjeli napraviti otopinu za razrjeđivanje kod kuće, u kuhinji ili u nekom drugom kemijskom laboratoriju. Na primjer, pravljenje soka od naranče od jednostavnog koncentrata je razrjeđenje. U mnogim slučajevima proizvod koji treba razrijediti sadrži podatke o razrjeđenju koje je potrebno napraviti, negdje na pakiranju. Možda imaju precizne upute kojih se trebaju pridržavati. Evo nekoliko stvari koje trebate tražiti kada tražite informacije:
- Korištena količina proizvoda
- Količina upotrijebljenog razrjeđivača
- Vrsta korištenog razrjeđivača (obično voda)
- Posebne upute za miješanje
- Možda nećete vidjeti podatke o točnoj koncentraciji upotrijebljene tekućine. Ove informacije nisu korisne prosječnom potrošaču.

Korak 2. U koncentriranu otopinu dodajte tvar koja djeluje kao razrjeđivač
Za jednostavna razrjeđivanja u kućanstvu, poput onih koja biste mogli napraviti u kuhinji, doista morate znati samo količinu volumena koncentrata koji koristite i približnu konačnu koncentraciju koju želite prije nego počnete. Koncentrat se razrijedi odgovarajućom količinom razrjeđivača, koja se određuje ovisno o volumenu korištenog početnog koncentrata. Pogledaj ispod:
- Na primjer, ako želimo razrijediti 1 šalicu koncentrata soka od naranče na 1/4 njegove početne koncentracije, dodali bismo 3 šalice vode u koncentrat. Naša će konačna smjesa imati 1 šalicu koncentrata u 4 šalice cijele tekućine - 1/4 njegove početne koncentracije.
- Evo složenijeg primjera: ako želimo razrijediti 2/3 šalice koncentrata na 1/4 njegove početne koncentracije, dodali bismo 2 šalice vode, jer je 2/3 šalice jednako 1/4 puta 2 i 2/3 šalice cijela tekućina.
- Dodajte svoju tvar u dovoljno veliku posudu da zadrži konačni volumen - veliku zdjelu ili sličnu posudu.

Korak 3. U većini slučajeva zanemarite volumen praha
Dodavanje praha (poput određenih mješavina pića) u tekućinu obično se ne smatra razrjeđivanjem. Promjena volumena koja nastaje dodavanjem male količine praha u tekućinu obično je dovoljno mala da je zanemariva. Drugim riječima, pri dodavanju male količine praha u tekućinu, samo dodajte prah u željeni konačni volumen tekućine i promiješajte.
Upozorenje
- Slijedite sve sigurnosne smjernice koje je dao proizvođač ili ih zahtijeva vaša tvrtka. To je osobito važno ako morate razrijediti otopinu kiseline.
- Rad s kiselim otopinama može zahtijevati detaljnije sigurnosne mjere i smjernice nego s nekiselinskim otopinama.






